強生、GE、美敦力、飛利浦...在中國召回醫械產品
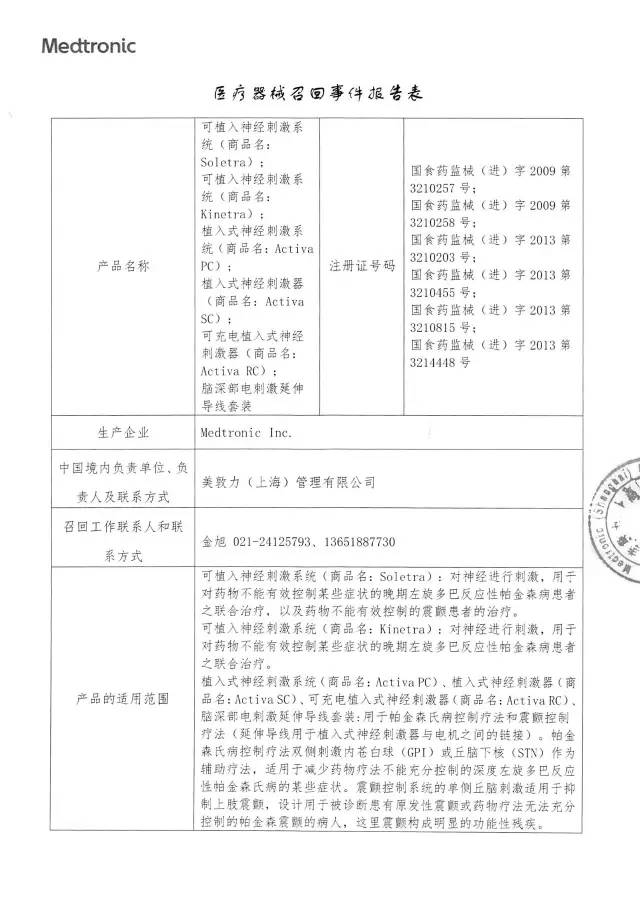
1、美敦力(上海)管理有限公司對可植入神經刺激系統、植入式神經刺激系統、植入式神經刺激器、可充電植入式神經刺激器、腦深部電刺激延伸導線套裝主動召回
美敦力(上海)管理有限公司報告:公司收到投訴,涉及兩個方面,一是患者在接受腦深部電刺激治療后喪失游泳能力(協調障礙),二是在制備隧道手術中使用腦深部電刺激時發生患者損傷。公司認為上述問題是腦深部電刺激治療過程的一個后續結果,與器械故障不相關,但需要增加相關警示。公司決定召回相關產品,本次召回級別為Ⅱ級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。

2、通用電氣醫療系統貿易發展(上海)有限公司對磁共振成像系統主動召回
通用電氣醫療系統貿易發展(上海)有限公司報告:企業發現,在磁體內壁的小范圍區域,在特定掃描狀態下產生的溫度對直接接觸或未使用填充墊的患者可能造成風險。公司決定召回相關產品,本次召回級別II級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。


3、碧迪醫療器械(上海)有限公司對比濁儀定標管(散射光濁度法)主動召回
碧迪醫療器械(上海)有限公司報告:公司發現涉及批次產品包裝盒標簽上所印刷到期日不正確。公司決定召回相關產品,本次召回級別為Ⅲ級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。

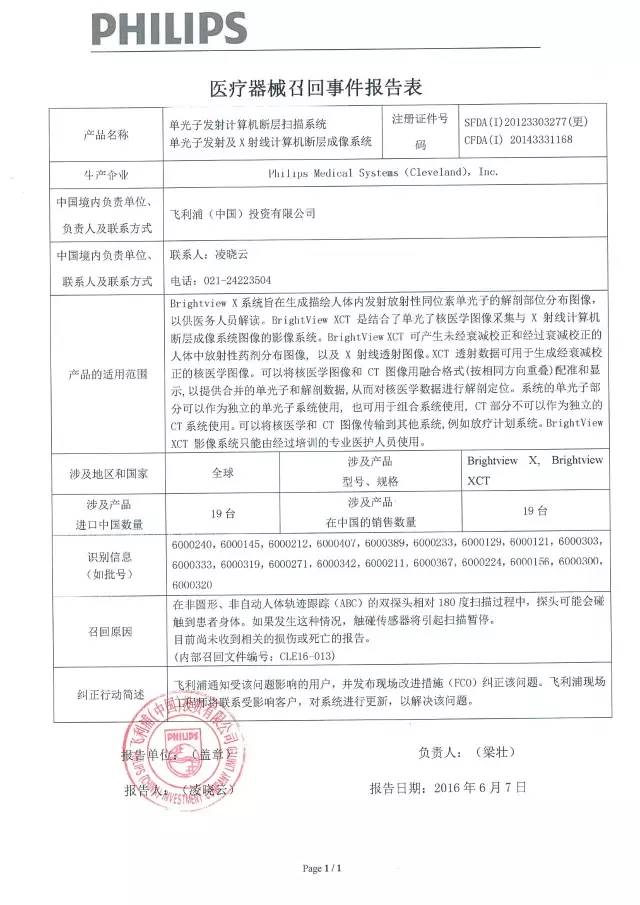
4、飛利浦(中國)投資有限公司對單光子發射計算機斷層掃描系統、單光子發射及X射線計算機斷層成像系統主動召回
飛利浦(中國)投資有限公司報告:在非圓形、非自動人體軌跡跟蹤的雙探頭相對180度掃描過程中,探頭可能會碰觸到患者身體。如果發生這種情況,碰觸傳感器將引起掃描暫停。公司決定召回相關產品,本次召回級別III級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。
5、飛利浦(中國)投資有限公司對X射線計算機斷層攝影設備主動召回
飛利浦(中國)投資有限公司報告:掃描床后蓋存在缺陷,可能會破裂,進而對未注意到損壞的操作人員、患者等現場人員造成潛在危害。公司決定召回相關產品,本次召回級別III級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。

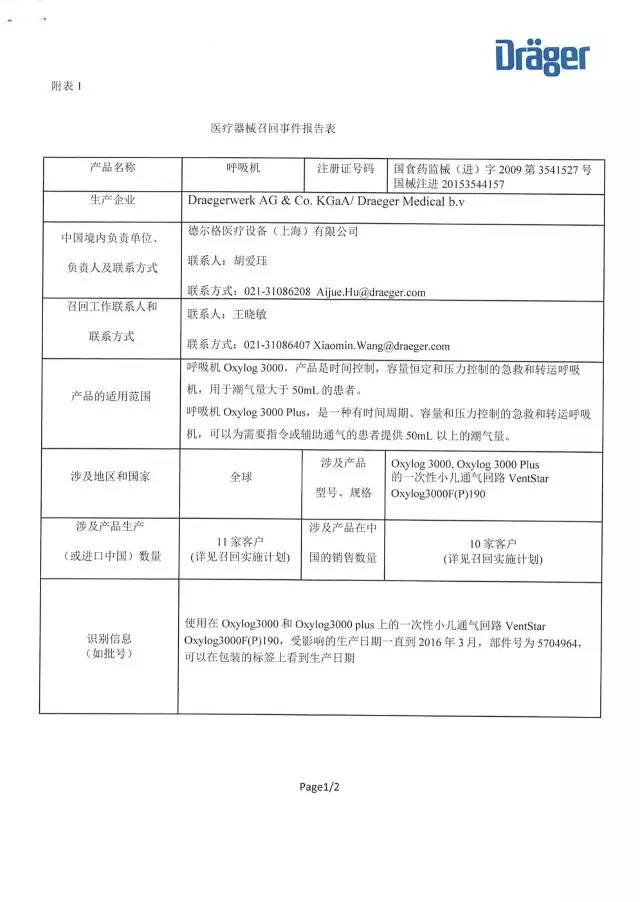
6、德爾格醫療設備(上海)有限公司對呼吸機主動召回
德爾格醫療設備(上海)有限公司報告:企業內部測試發現涉及產品的一次性小兒通氣回路存在單向閥泄漏問題,單向閥的泄漏可能導致病人呼出的氣體進入呼吸回路,這樣病人可能重復吸入已呼出的氣體,導致氧氣濃度會降低。公司決定召回相關產品,本次召回級別I級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。

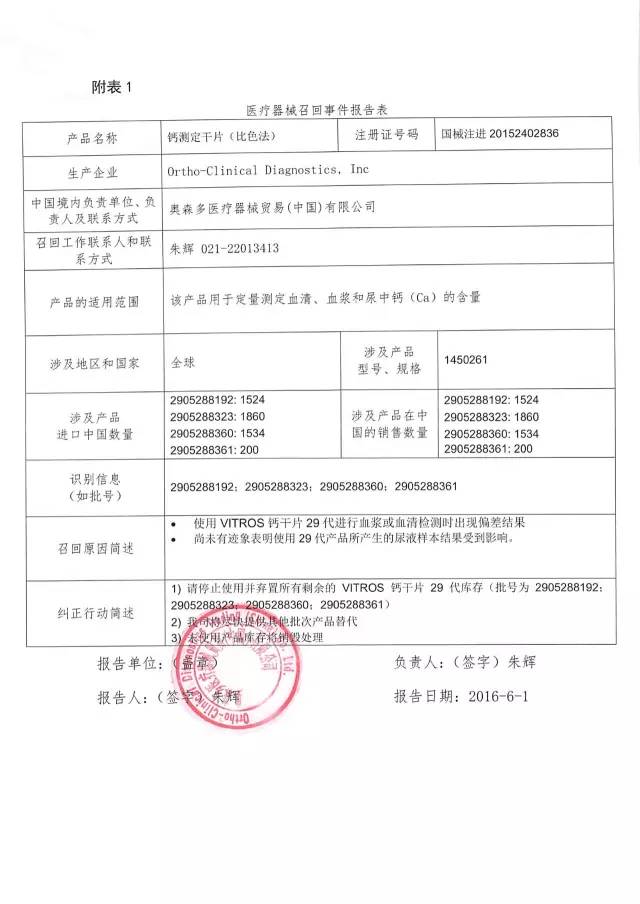
7、奧森多醫療器械貿易(中國)有限公司對鈣測定干片(比色法)主動召回
奧森多醫療器械貿易(中國)有限公司報告:企業發現,涉及產品進行血漿或血清檢測時出現偏差結果。公司決定召回相關產品,本次召回級別II級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。
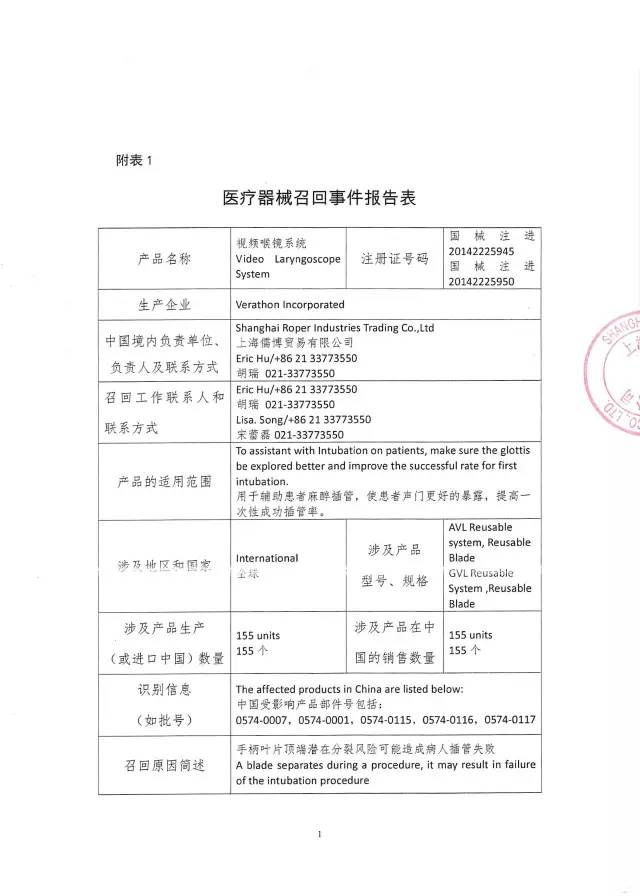
8、上海儒博貿易有限公司對視頻喉鏡系統主動召回
上海儒博貿易有限公司報告:涉及產品的手柄葉片頂端存在分裂風險可能造成病人插管失敗。公司決定召回相關產品,本次召回級別為Ⅱ級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。

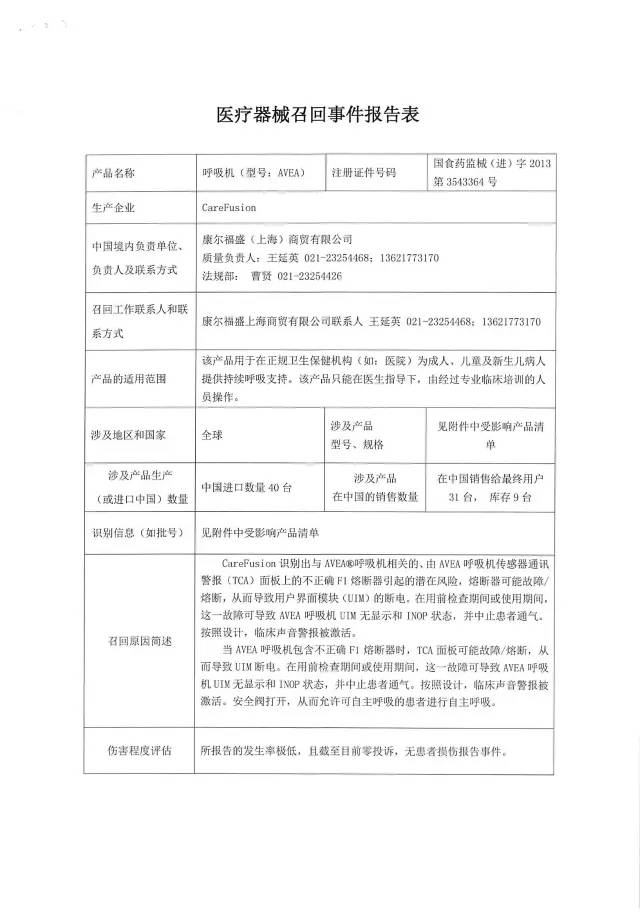
9、康爾福盛(上海)商貿有限公司對呼吸機主動召回
康爾福盛(上海)商貿有限公司報告:涉及產品傳感器通訊警報面板上的熔斷器存在缺陷,導致用戶界面斷電無顯示,并中止患者通氣。公司決定召回相關產品,本次召回級別為III級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。

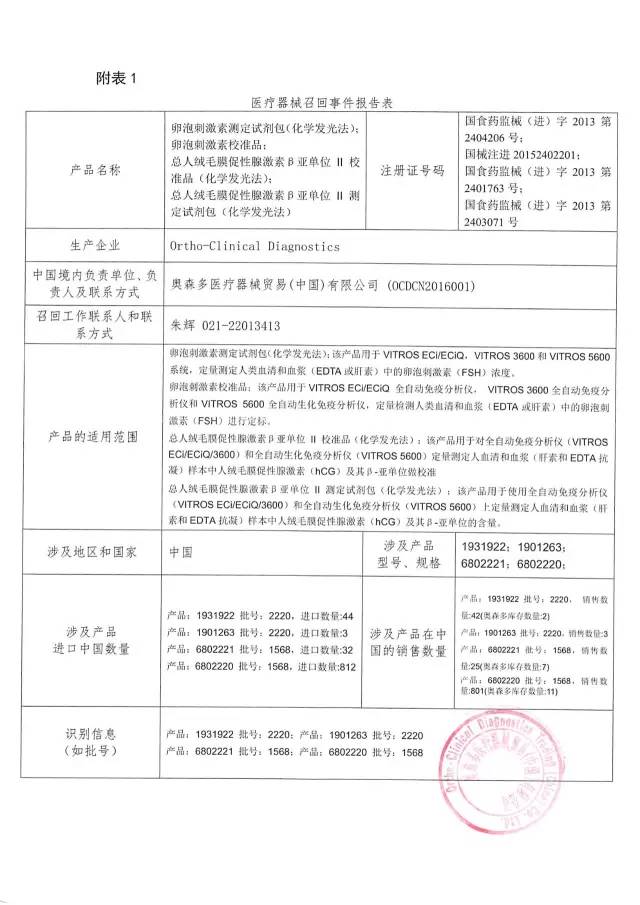
10、奧森多醫療器械貿易(中國)有限公司對卵泡刺激素測定試劑包(化學發光法)、卵泡刺激素校準品、總人絨毛膜促性腺激素β亞單位II校準品(化學發光法)、總人絨毛膜促性腺激素β亞單位II測定試劑包(化學發光法)主動召回
奧森多醫療器械貿易(中國)有限公司報告:企業發現,由于注冊證變更,變更內容為:生產商注冊地址變更、代理人變更,導致產品的標識信息與注冊證信息不一致。公司決定召回相關產品,本次召回級別III級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。

11、銳珂(上海)醫療器材有限公司對多功能醫療影像處理及管理系統軟件主動召回
銳珂(上海)醫療器材有限公司報告:公司發現,用戶將ImageSuite軟件用于接收計算機斷層掃描和核磁影像時,如果影像帶有特定的(患者)影像方位標記,并且配置為在影像上疊加顯示該標記時,標記L(左)和R(右)以及A(前)和P(后)的顯示可能會正好相反。公司決定召回相關產品,本次召回級別為Ⅱ級,涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。

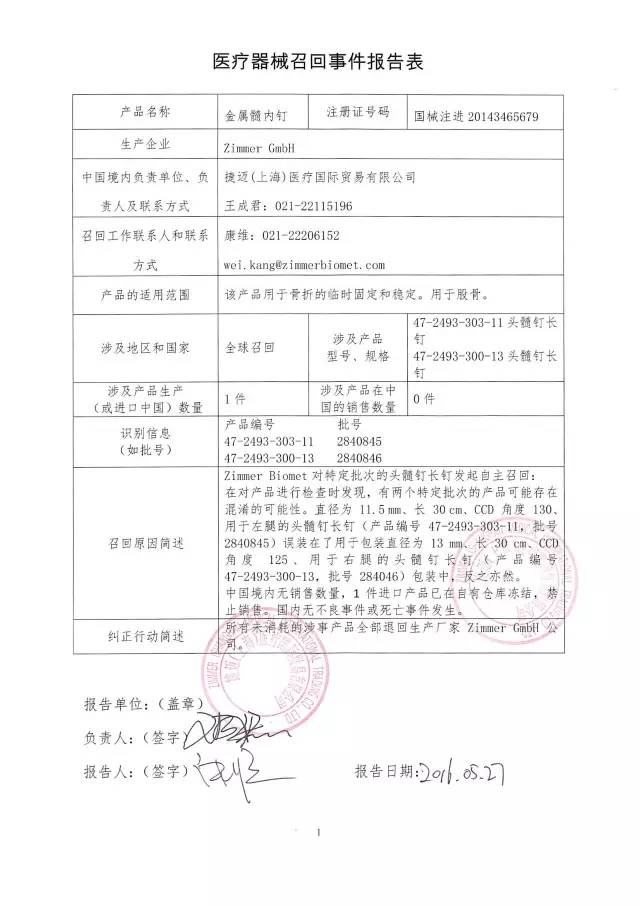
12、捷邁(上海)醫療國際貿易有限公司對金屬髓內釘主動召回
捷邁(上海)醫療國際貿易有限公司報告:公司發現有兩個特定批次產品可能存在包裝混淆,導致產品實際尺寸與包裝標識不一致。公司主動召回相關產品。召回級別為II級。涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。
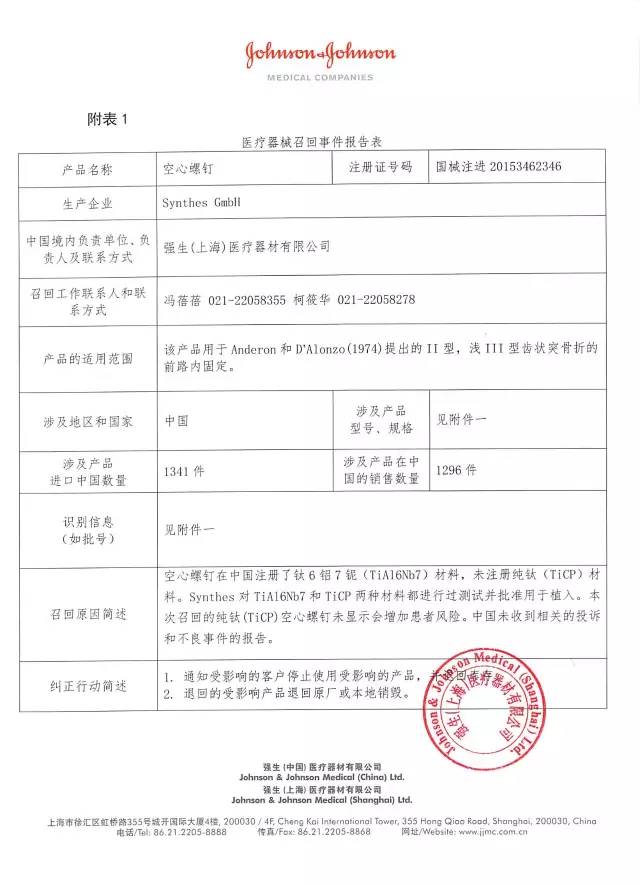
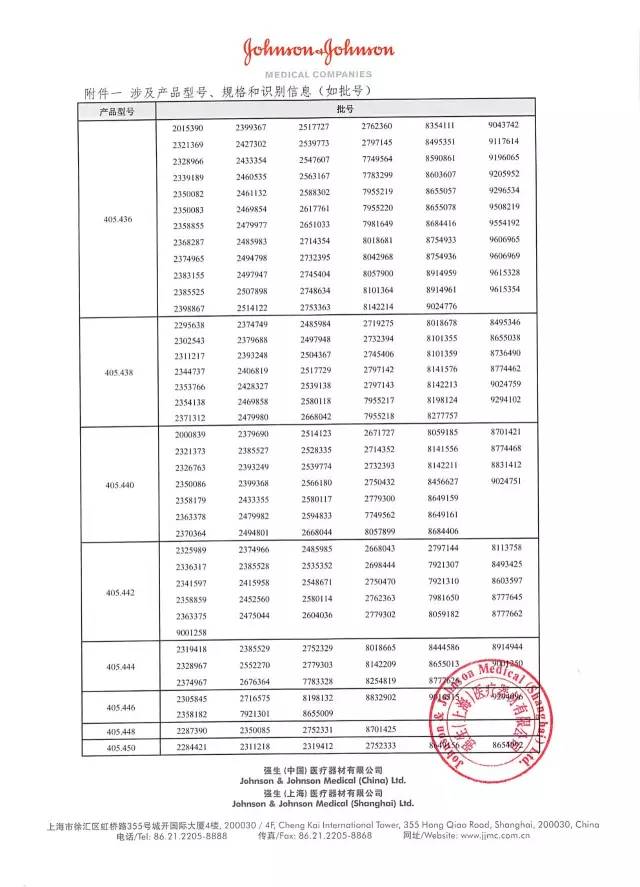
13、強生(上海)醫療器材有限公司對空心螺釘主動召回
強生(上海)醫療器材有限公司報告:公司未注冊純鈦材料的空心螺釘,上市銷售純鈦材料的空心螺釘不符合中國法規。公司主動召回相關產品。召回級別為III級。涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。

14、強生(上海)醫療器材有限公司對補片主動召回
強生(上海)醫療器材有限公司報告:公司研究發現涉及產品的復發率或再次手術率高于其它補片的平均復發率。公司主動召回相關產品。召回級別為II級。涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。


來源:上海藥監局 整理:中國醫療器械

相關閱讀
- 最新排名出爐:2020全球頂級醫療企業TOP102021-02-05
- 21省耗材帶量采購:美敦力、雅培、微創、樂普…2021-01-14
- 知名械企分食170億市場:美敦力、史賽克、威高...2021-01-12
- 山西省醫用耗材談判結果公布:強生、威高、巴德…2021-01-08
- 第二輪全國耗材集采名單公布:美敦力、雅培、威高…2020-12-23






