總局2015年度醫療器械注冊工作報告
2015年,國家食品藥品監督管理總局(以下簡稱食品藥品監管總局)以維護和促進公眾健康為己任,深入貫徹落實《醫療器械監督管理條例》(國務院令第650號)和《國務院關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號),推進醫療器械審評審批制度改革,規范和指導全國醫療器械注冊工作,提升醫療器械注冊審評質量與效率。
一、醫療器械注冊工作情況
依據《醫療器械監督管理條例》,食品藥品監管總局負責境內第三類和進口第二、三類醫療器械注冊受理、技術審評和行政審批工作。省級食品藥品監督管理部門負責境內第二類醫療器械注冊受理、技術審評和行政審批工作。
(一)完善醫療器械注冊管理法規體系
制定發布了《醫療器械分類規則》《醫療器械通用名稱命名規則》《醫療器械臨床評價技術指導原則》《境內第三類醫療器械注冊質量管理體系核查工作程序》等16個規章及規范性文件。進一步完善了醫療器械注冊管理法規體系,規范了醫療器械技術審查、注冊核查等相關工作,為各級食品藥品監管部門注冊管理工作和行政相對人注冊申報工作的有序開展提供了良好的法規基礎。
(二)推進醫療器械審評審批制度改革
2015年,食品藥品監管總局醫療器械技術審評中心研究制定了審評機制改革實施方案,進一步加強了審評員崗前培訓和繼續教育培訓工作,提升審評員綜合素質。
食品藥品監管總局審核發布了《有源植入式醫療器械》等28項國家標準和《血液透析及相關治療用水》等90項行業標準。制定了《醫療器械分類管理改革工作方案》,成立醫療器械分類技術委員會,啟動《醫療器械分類目錄》修訂工作。繼續按照《創新醫療器械特別審批程序(試行)》做好創新醫療器械審查工作,推動醫療器械行業創新發展。
(三)開展省級醫療器械審評審批能力考核評估
食品藥品監管總局發布了《關于加強省級醫療器械技術審評能力建設的指導意見》,組織制定了《省級醫療器械審評審批能力考核評估工作方案》,并組織開展了省級醫療器械審評審批能力考核試點評估工作,促進了省級食品藥品監管部門注冊管理水平和質量的提升。
(四)加強注冊基礎工作建設
食品藥品監管總局繼續推動醫療器械注冊技術審查指導原則的制修訂工作,共發布“乙型肝炎病毒基因分型檢測試劑”等12個產品注冊技術指導原則和“軟性親水接觸鏡”等2項說明書編寫指導原則。截至2015年底共發布醫療器械注冊技術審查指導原則125項。通過指導原則的發布,進一步統一了特定醫療器械注冊在全國范圍內尺度,也為管理相對人辦理注冊申報提供了有效指導。
2015年9月10日,食品藥品監管總局上線啟用了醫療器械注冊管理第一類備案子系統,規范、指導了各地第一類醫療器械備案工作。2015年12月20日,上線啟用了食品藥品監管總局醫療器械注冊管理新系統,規范注冊電子申報要求,提升審查工作的信息化水平和工作效率。
二、醫療器械注冊申請受理情況
2015年,食品藥品監管總局共受理醫療器械(體外診斷試劑)注冊申請9396項,其中,首次注冊申請2402項,延續注冊申請5105項,許可事項變更申請1889項,同比2014年相應注冊受理項目減少6.7%。
(一)整體情況
2015年,受理境內第三類醫療器械(體外診斷試劑)注冊申請3921項,受理進口醫療器械(體外診斷試劑)注冊申請5475項。
按注冊品種區分,醫療器械注冊申請5509項,體外診斷試劑注冊申請3887項。
按注冊形式區分,首次注冊申請2402項,延續注冊申請5105項,許可事項變更申請1889項。
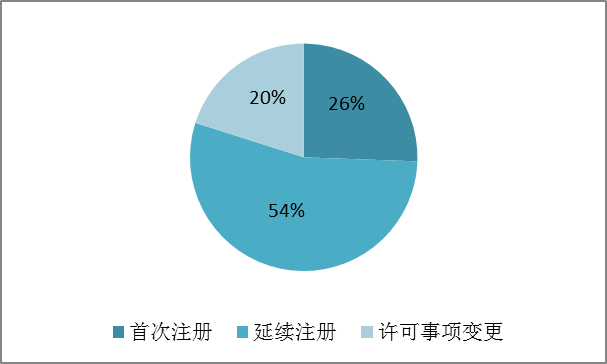
圖1.注冊形式比例圖
(二)分項情況
1.境內第三類醫療器械注冊受理情況
2015年,境內第三類醫療器械注冊受理共3921項。其中,醫療器械注冊申請2219項,體外診斷試劑注冊申請1702項。
從注冊形式看,首次注冊申請1562項,占40%;延續注冊申請1635項,占42%;許可事項變更注冊申請724項,占18%。
2.進口第二類醫療器械注冊受理情況
2015年,進口第二類醫療器械注冊受理共3024項。其中醫療器械注冊申請1339項,體外診斷試劑注冊申請1685項。
從注冊形式看,首次注冊申請499項,占17%;延續注冊申請1895項,占63%;許可事項變更注冊申請,占20%。
3.進口第三類醫療器械注冊受理情況
2015年,進口第三類醫療器械注冊受理共2451項。其中醫療器械注冊申請1951項,體外診斷試劑注冊申請500項。
從注冊形式看,首次注冊申請341項,占14%;延續注冊申請1575項,占64%;許可事項變更注冊申請535項,占22%。
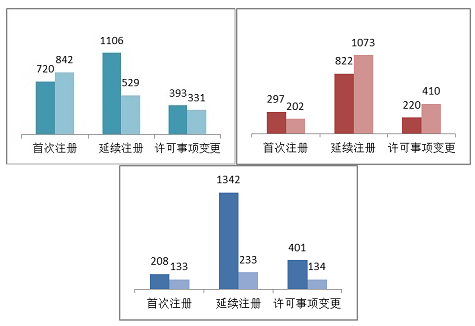
圖2.境內第三類、進口第二類和第三類注冊形式分布圖
綜上,境內第三類體外診斷試劑首次注冊申請數量多于延續注冊數量外,境內第三類醫療器械、進口醫療器械和體外診斷試劑均是延續注冊申請數量多于首次注冊申請數量。而無論是境內第三類還是進口醫療器械,其許可事項變更注冊申請大致相當,均為20%左右。
三、醫療器械注冊審評審批情況
(一)整體情況
2015年,食品藥品監管總局共批準醫療器械注冊7530項。其中,首次注冊2707項,延續注冊4072項,許可事項變更注冊751項。與2013、2014年相比,注冊批準總數量略有下降。
2015年食品藥品監管總局共對1297項醫療器械注冊申請不予注冊。
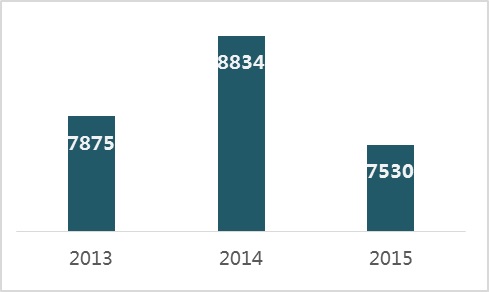
圖3.2013-2015年度注冊數據圖
其中境內第三類醫療器械(含體外診斷試劑)注冊2730項,進口第二類、第三類醫療器械(含體外診斷試劑)4800項。
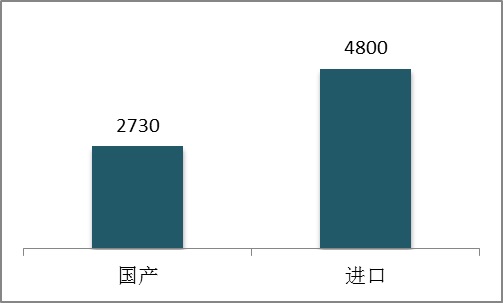
圖4.2015年度國產和進口醫療器械注冊數據圖
按照注冊品種區分,其中醫療器械4823項,體外診斷試劑2707項,二者比例約為6:4。按照注冊形式區分,具體比例分布見下圖。
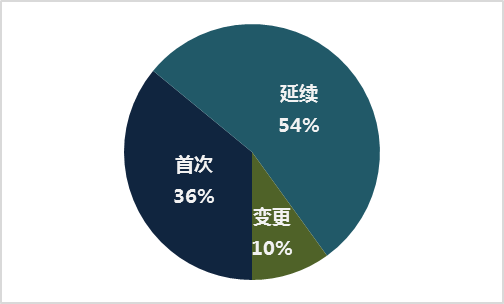
圖5.注冊形式比例圖
(二)分項統計情況
1.境內第三類醫療器械(體外診斷試劑)
境內第三類醫療器械首次注冊334項,延續注冊1074項,許可事項變更注冊86項。
境內第三類體外診斷試劑首次注冊514項,延續注冊479項,許可事項變更243項。
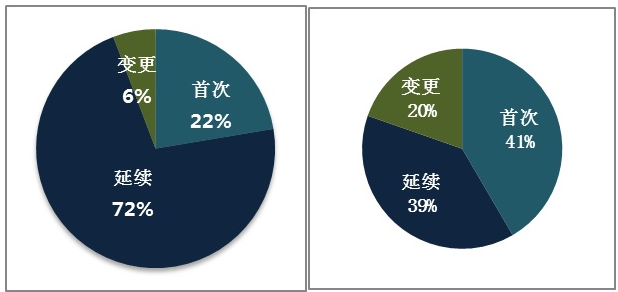
圖6.境內第三類醫療器械和體外診斷試劑注冊形式比例圖
2.進口醫療器械(體外診斷試劑)
進口醫療器械首次注冊1533項,延續注冊1640項,許可事項變更注冊156項。
進口體外診斷試劑首次注冊326項,延續注冊879項,許可事項變更注冊266項。
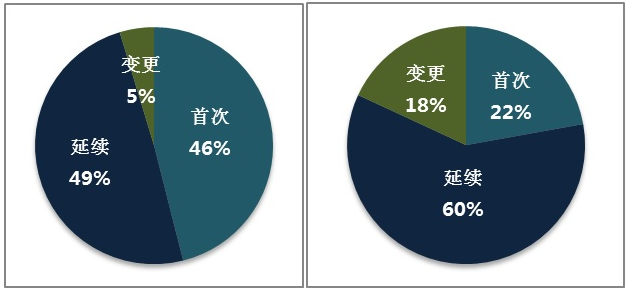
圖7.進口醫療器械和體外診斷試劑注冊形式比例圖
綜上,從批準的產品整體情況看,延續注冊批準數量多于首次注冊批準數量,對于境內第三類體外診斷試劑,其首次注冊數量多于延續注冊數量。
3.具體批準品種種類分析
從首次和延續注冊數據看,體外診斷試劑在相應注冊中產品比率占據明顯優勢。
其中,境內第三類醫療器械中,體外診斷試劑注冊數量占全部注冊比率45%,進口醫療器械中,體外診斷試劑比率達31%。
2015年,注冊的境內第三類醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中26個子目錄中產品。
注冊數量前五位的境內第三類醫療器械是:醫用高分子材料及制品,植入材料和人工器官,注射穿刺器械,醫用光學器具、儀器及內窺鏡設備,介入器材。
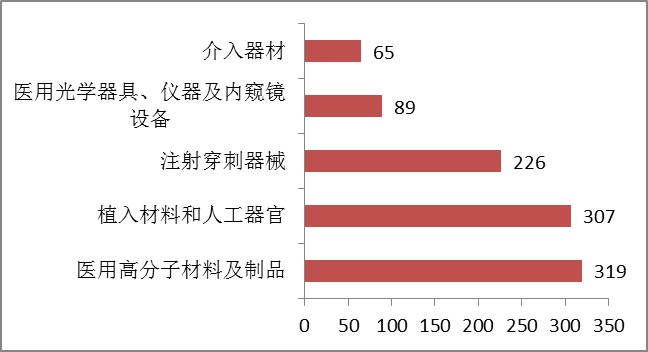
圖8.境內第三類醫療器械注冊品種排位圖
2015年,注冊的進口醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中41個子目錄中產品。
注冊數量前五位的進口醫療器械,主要是:醫用光學器具、儀器及內窺鏡設備,植入材料和人工器官,口腔科材料,醫用電子儀器設備,醫用高分子材料及制品。
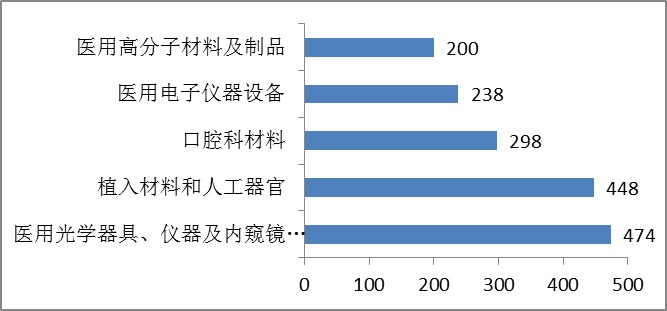
圖9.進口醫療器械注冊品種排位圖
4.進口醫療器械國別分析
2015年,美國、德國、日本、英國和韓國醫療器械在中國醫療器械注冊數量排前五位,約占2015年進口產品首次、延續注冊總數量的67%。
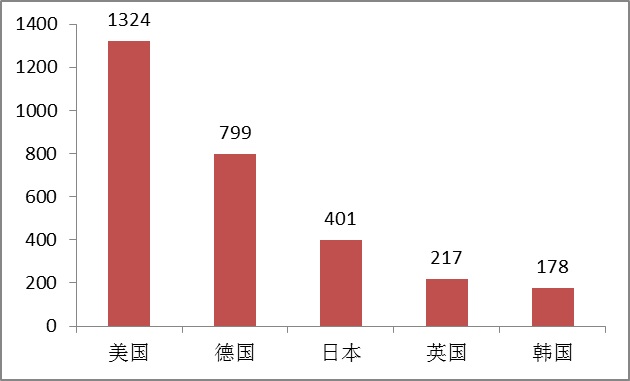
圖10.進口醫療器械國別注冊排位圖
5.境內第三類醫療器械省份分析
從2015年境內第三類醫療器械注冊情況看,相關注冊產品生產企業主要集中在沿海經濟較發達省份。
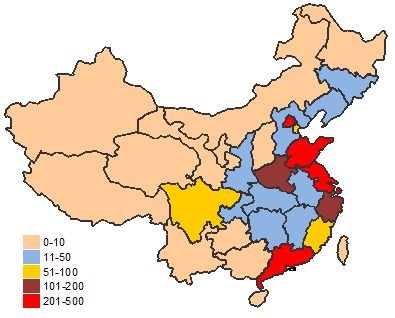
圖11.境內第三類醫療器械省份注冊分布圖
其中,北京、江蘇、廣東、上海、山東是境內第三類醫療器械注冊數量最多的省份,占2015年境內第三類醫療器械首次、延續注冊數量的67%。
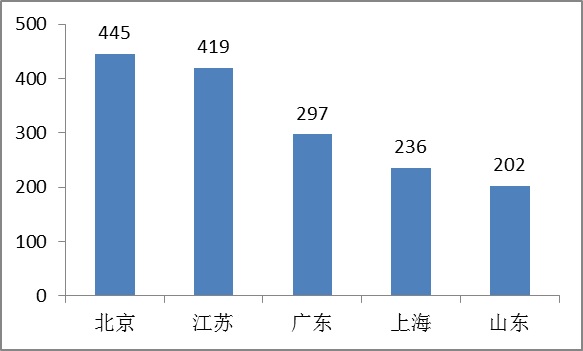
圖12.境內第三類醫療器械注冊省份排位圖
四、創新醫療器械等產品審評審批情況
2015年,食品藥品監管總局按照《創新醫療器械特別審批程序(試行)》,繼續做好創新醫療器械審查工作,并批準了部分創新醫療器械產品上市。
2015年,食品藥品監管總局共收到創新醫療器械特別審批申請157項,完成166項審查(含2014年申請事項),審查確定29個產品可以進入創新醫療器械特別審批通道。批準注冊脫細胞角膜基質等9個產品上市。其中,有源醫療器械5項,體外診斷試劑3項,無源醫療器械1項。
這些創新產品核心技術都有我國的發明專利權或者發明專利申請已經國務院專利行政部門公開,產品主要工作原理/作用機理為國內首創,具有顯著的臨床應用價值。
(一)恒溫擴增微流控芯片核酸分析儀(國械注準20153400580,博奧生物集團有限公司)。該儀器將微流控芯片技術與恒溫擴增技術相結合,可同時對多個核酸靶序列進行高通量并行檢測。與配套體外診斷試劑聯合使用,用于對人體生物樣本中的核酸(DNA)進行檢測。
(二)脫細胞角膜基質(國械注準20153460581,深圳艾尼爾角膜工程有限公司)。用于用藥無效的尚未穿孔角膜潰瘍的治療,以及角膜穿孔的臨時性覆蓋。是我國首個人工角膜產品,為角膜潰瘍患者提供了新的治療選擇。
(三)雙通道植入式腦深部電刺激脈沖發生器套件、植入式腦深部電刺激電極導線套件和植入式腦深部電刺激延伸導線套件。(國械注準20153210970、國械注準20153210971、國械注準20153210972,蘇州景昱醫療器械有限公司)。上述產品配合使用,對丘腦底核(STN)進行刺激, 用于對藥物不能有效控制運動障礙癥狀的晚期原發性帕金森患者的治療。
(四)MTHFR C677T 基因檢測試劑盒(PCR-金磁微粒層析法)(國械注準20153401148,西安金磁納米生物技術有限公司)。用于從人外周血提取的基因組DNA中定性檢測亞甲基四氫葉酸還原酶(MTHFR)C677T的基因型。可快速、便捷實現對目標基因位點的分型,為輔助診斷高同型半胱氨酸水平或葉酸代謝異常患者提供更多手段。
(五)Septin9基因甲基化檢測試劑盒(PCR熒光探針法)。(國械注準20153401481,博爾誠(北京)科技有限公司)用于體外定性檢測人外周血血漿中Septin9基因甲基化,為病人提供了一種非創性結直腸癌輔助診斷方法的選擇。
(六)乳腺X射線數字化體層攝影設備(國械注準20153302052,科寧(天津)醫療設備有限公司)。用于乳腺疾病的診斷和鑒別診斷。是我國境內首例真實三維乳腺成像系統,解決了鉬靶成像的乳腺組織重疊問題,可在不擠壓乳房的情況下采集乳腺的CT斷層影像,采集圖像在三個坐標軸上具有相同的空間分辨率,能夠更好地檢測定性鈣化簇和其三維分布,同時可用于評估腫瘤血管的生成。
(七)運動神經元存活基因1(SMN1)外顯子缺失檢測試劑盒(熒光定量PCR法)(國械注準20153402293,上海五色石醫學研究有限公司)。該產品采用多重實時熒光MGB-TaqMan探針PCR法,對SMN1基因第7外顯子和第8外顯子拷貝數進行相對定量檢測,用于脊肌萎縮癥(SMA)患者的體外輔助分子診斷。
食品藥品監管總局2015年還批準了部分有較好臨床應用前景的醫療器械產品注冊。如:
(一)粒子治療設備(國械注進20153320876,Siemens AG),是2015年食品藥品監管總局批準的中國首臺質子/碳離子治療系統,用于治療全身實體惡性腫瘤及某些良性疾病。
(二)正電子發射磁共振成像系統(國械注進20153282530,Siemens AG和國械注進20153333982,GE Medical Systems,LLC),結合了磁共振診斷設備和正電子發射斷層成像掃描系統,能通過同步和等中心方式采集的生理、解剖等信息。
(三)左心耳封堵器(國械注進20153773158,St.Jude Medical Coordination Center BVBA),是近期發展的經皮介入治療非瓣膜性心房顫動患者心源性卒中的植入器械,繼2013年食品藥品監管總局批準Boston Scientific Ireland Limited公司相應產品后,2015年再次批準一個產品,是目前生產企業研發的熱點產品。
(四)超高效液相串聯質譜系統及試劑(國械注進20152400515、國械注進20152401820,Waters Corporation),該產品主要用于分析包括診斷指示物和治療監控化合物等多種化合物,對于部分新的治療藥物監測方面,該系統可以做到直接建立檢測方法,在微量檢測方面比現有方法更為精確。
(五)部分新病原體檢測試劑,如人鼻病毒核酸檢測試劑盒(PCR-熒光探針法)、人博卡病毒核酸檢測試劑盒(PCR-熒光探針法)(國械注準20153400295、國械注準20153400294,湖北朗德醫療科技有限公司)等,給臨床相關病原體感染診斷提供了有效的工具。
2015年,在醫療器械應急產品審查方面,食品藥品監管總局根據《醫療器械應急審批程序》要求,經組織專家論證,批準了5家企業的中東呼吸綜合征冠狀病毒檢測試劑進入應急審批程序。繼2014年審查批準3個埃博拉病毒應急檢測試劑審批的基礎上,2015年再次批準2個埃博拉病毒檢測試劑:埃博拉病毒(扎伊爾型)核酸檢測試劑盒(PCR-熒光探針法) (國械注準20153400327,華大生物科技(武漢)有限公司),埃博拉病毒(扎伊爾型)核酸檢測試劑盒(PCR-熒光探針法) (國械注準20153400224,蘇州天隆生物科技有限公司)
五、其他信息
(一)境內第二類醫療器械注冊情況
2015年,各省級食品藥品監管部門共批準境內第二類醫療器械注冊12284項。其中首次注冊5566項,延續注冊4918項,許可事項變更注冊1800項。
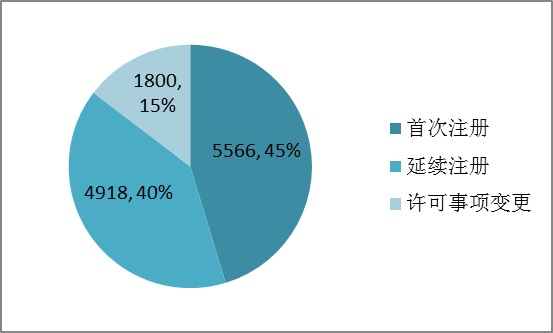
圖13.境內第二類醫療器械注冊形式比例圖
各省份分項數據:
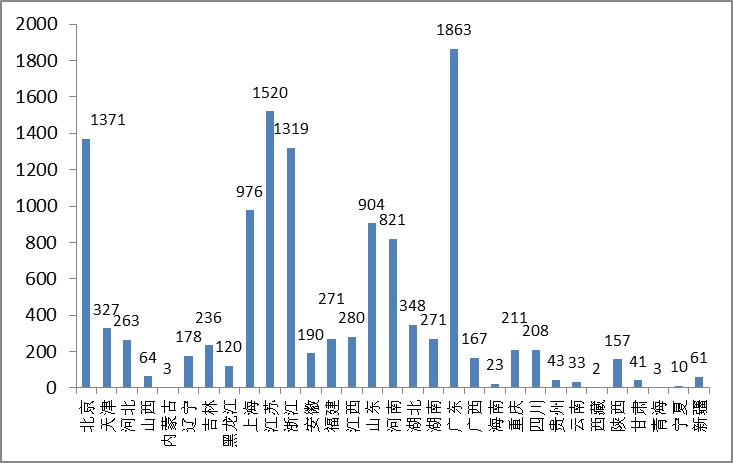
圖14.境內第二類醫療器械省份注冊數據圖
從省級食品藥品監管部門注冊情況看,廣東、江蘇、北京、浙江、上海、山東、河南七省(直轄市)注冊的境內第二類醫療器械數量較多。
(二)一類醫療器械備案情況
2015年,食品藥品監管總局依職責共辦理進口第一類醫療器械備案數量2488項。
全國設區的市級食品藥品監管部門共依職責辦理境內第一類醫療器械備案數量13516項。
(三)登記事項變更情況
2015年,食品藥品監管總局依職責共辦理進口第二、三類和境內第三類醫療器械登記事項變更4691項。其中,境內第三類醫療器械登記事項變更1590項,進口第二類、三類醫療器械登記事項變更3101項。
全國各省級食品藥品監管部門共依職責辦理境內第二類醫療器械登記事項變更5255項。

相關閱讀
- 2022年底上海第二類醫療器械產品注冊周期縮短至6-7個月2021-05-21
- 這些耗材,多省不予上市!2021-03-10
- 上海自貿區“證照分離”有了升級版 醫療器械注冊證試行2017-12-18
- 新版醫療器械分類目錄實施在即2017-05-27
- 醫療器械召回管理辦法落地 徹底影響械企!2017-05-02






