2016三大類醫療器械將不再享受備案后直接上市
發布時間:2016/1/4 11:00:55
醫械圈內的人都知道第一類醫械在醫械圈內很吃香,因為國家2014年6月1日發布了《醫療器械監督管理條例》開始實施,將第一類醫療器械上市許可由原來的注冊審批制改為備案制。也就是說凡是在《第一類醫療器械產品目錄》內的第一類醫療器械只需要備案后即可上市,無需注冊。這樣就免除了注冊費的成本。
2015年7月配套發布了《醫療器械分類規則》(國家食品藥品監管總局令第15號),新分類將于2016年1月1日起施行,圍繞一類目錄及豁免臨床的二類、三類產品,對結構組成、預期用途等都加上了較為具體和細致的描述,企業在使用目錄時不能像過去僅從產品名稱出發,而應從產品屬性出發,即工程原理、分類規則的要素等,尋找產品在目錄中的正確位置。
同時,CFDA還規定本規則自2016年1月1日起施行。2000年4月5日公布的《醫療器械分類規則》(原國家藥品監督管理局令第15號)同時廢止。
以下是按照新的《醫療器械分類規則》整理的分類判定表

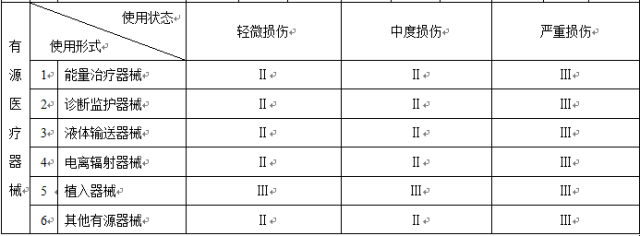

注:1.本表中“Ⅰ”、“Ⅱ”、“Ⅲ”分別代表第一類、第二類、第三類醫療器械;
2.本表中“-”代表不存在這種情形。
和之前的分類列表相比,大家可以看出:在接觸人體醫械中,一次性無菌外科器械被取消了,不在分為第一類醫械;而在非接觸人體醫械中,體外診斷試劑被取消了,不會按照第一類醫械管理,而醫療器械消毒滅菌設備也沒有歸類在第一類醫療器械中,也就是說這三類醫械將不再享受備案后直接上市的福利。

相關閱讀
- 《醫療器械標準管理辦法》正式出臺 7月1日起施行2017-04-27
- 倒查1年,第一類器械備案問題也要大整改2016-06-27
- 政府福利 醫療器械行業被全面覆蓋2015-12-31
- 上海第一類醫療器械備案即可上市 不再實行注冊審批制2015-12-23
- 解讀 《醫療器械注冊管理辦法》法規2015-11-05






