MD&IVD注冊審評審批流程及時限
發布時間:2015/1/15 10:49:25
《醫療器械注冊管理辦法》(總局令第4號)及《體外診斷試劑注冊管理辦法》(總局令第5號)實施后,相關行政許可事項的審評審批時限有增有減。這一點我們在之前的推送中為您進行了詳細的對比。
依據2014版《注冊管理辦法》,一般的審評審批流程包括:受理、資料承轉、技術審評、再次技術審評(針對補充資料)行政審批、制證發布。今天我們為您詳細梳理申請不同行政許可事項時,面臨的不同流程,各環節時限與總時限。
特別需要說明的是,此次發布的內容包含了對之前發布內容的勘誤,主要針對“延續注冊的審評審批流程及時限”部分。由于《注冊管理辦法》未明確延續注冊技術審評時限,因此依據受理中心與器械注冊司對此疑問的口頭答復制定下表。希望該內容對大家有所幫助!
上述的一般審評審批流程及相應時限未包括以下情況:
1.需要外聘專家審評的,
2.藥械組合產品需與藥品審評機構聯合審評的,
3.審評期間組織對申請人進行與產品研制、生產有關的質量管理體系核查的。
另外,2014版《注冊管理辦法》對于“境內”及“境外”產品在“審評審批時限”方面的規定無區別。因此,下列表格對于境內及境外產品均適用。
以下是詳細內容(注:表格中標記“—”表示該流程不包含本環節):
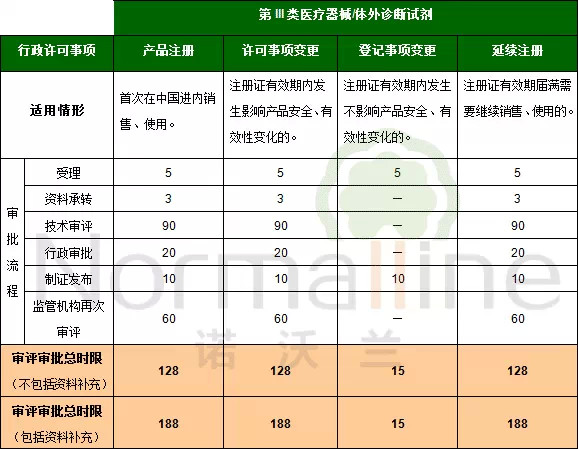
第III類醫療器械或體外診斷試劑產品
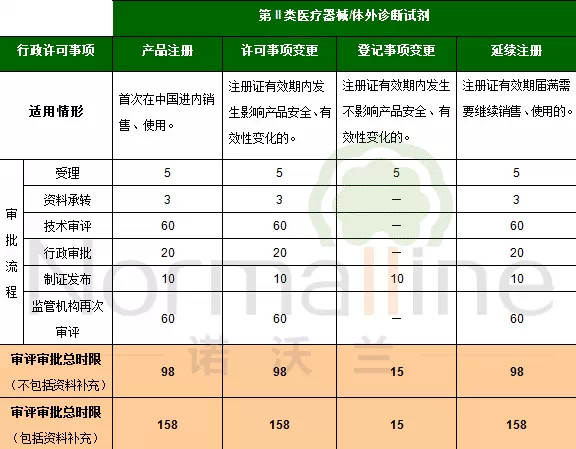
第II類醫療器械/體外診斷試劑
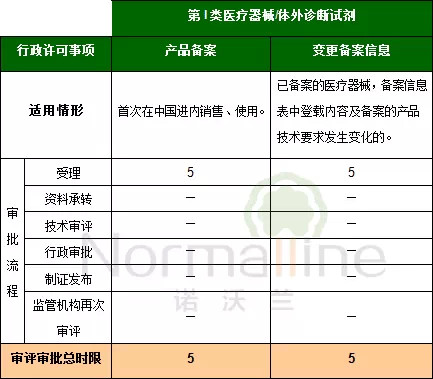
第I類醫療器械/體外診斷試劑

相關閱讀
- CFDA|8項體外診斷試劑技術指導原則發布!2018-01-18
- 干貨!2016年基因檢測行業分析2016-12-07
- 為何IVD在醫療器械圈內這么火2015-11-18
- 食品藥品監管總局辦公廳關于經營體外診斷試劑相關問題的復函2015-11-03
- 醫械新版GMP的痛點和機遇2015-08-04






