醫療器械標準管理工作現狀,及后續工作的思考
深度 | 醫療器械標準管理現狀及思考
醫療器械標準是醫療器械監管的技術依據,是對醫療器械行業發展和監督管理具有重大影響力的技術文件,是我國醫療器械行業發展水平的重要標志,在指導醫療器械設計、生產、使用和服務于監管等方面均發揮著重要作用。
隨著醫療器械產業的飛速發展和人民醫療需求的不斷提高,作為醫療器械科學監管的基礎,醫療器械標準被提升到了空前重要的位置。本文將重點分析醫療器械標準管理工作現狀,并提出后續工作的思考。
醫療器械標準管理工作現狀
1.醫療器械標準管理法規體系
2002 年,原國家藥品監督管理局發布施行《醫療器械標準管理辦法(試行)》(原局令第31 號),對指導我國醫療器械標準化管理工作、規范標準制修訂以及促進標準實施等起到了積極的推動作用。隨著醫療器械標準化工作的不斷發展,原國家藥品監督管理局于2010 年組建成立醫療器械標準管理中心,進一步加強了醫療器械標準的組織管理,醫療器械標準管理體系發生改變。2014年6 月,國務院頒布《醫療器械監督管理條例》(國務院令第650號)(以下簡稱《條例》),取消注冊產品標準,明確產品技術要求的法律地位,改變了原有醫療器械國家標準、行業標準和注冊產品標準組成的三級標準體系,醫療器械標準體系隨之發生了變化。配合《醫療器械監督管理條例》的實施,2017 年4 月和12 月,原國家食品藥品監督管理總局先后發布《醫療器械標準管理辦法》和《醫療器械標準制修訂工作管理規范》,指導我國醫療器械標準科學化管理,進一步規范標準制修訂工作,加強標準制修訂過程公開透明度,從而促進標準實施,促進醫療器械質量提升。
2.醫療器械標準管理組織架構
根據《醫療器械標準管理辦法》,醫療器械標準管理組織架構包括五級結構,依次是國家藥品監督管理局,醫療器械標準管理中心,醫療器械標準化(分)技術委員會(歸口單位),地方食品藥品監督管理部門,醫療器械研制、生產經營企業和使用單位等。其中國家藥品監督管理局負責建立醫療器械標準管理相關法律法規和標準體系規劃以及監督指導醫療器械標準管理工作;醫療器械標準管理中心負責統籌協調標準制修訂管理、標準化技術委員會管理以及標準實施等工作;醫療器械標準化(分)技術委員(歸口單位)對醫療器械標準的技術負責并承擔對標準實施情況進行跟蹤評價等工作;地方食品藥品監督管理部門負責依法監督醫療器械標準實施并收集反饋問題;研發、生產經營和使用等相關單位應當貫徹執行醫療器械強制性標準,積極采用推薦性標準,并積極參與標準制修訂工作。
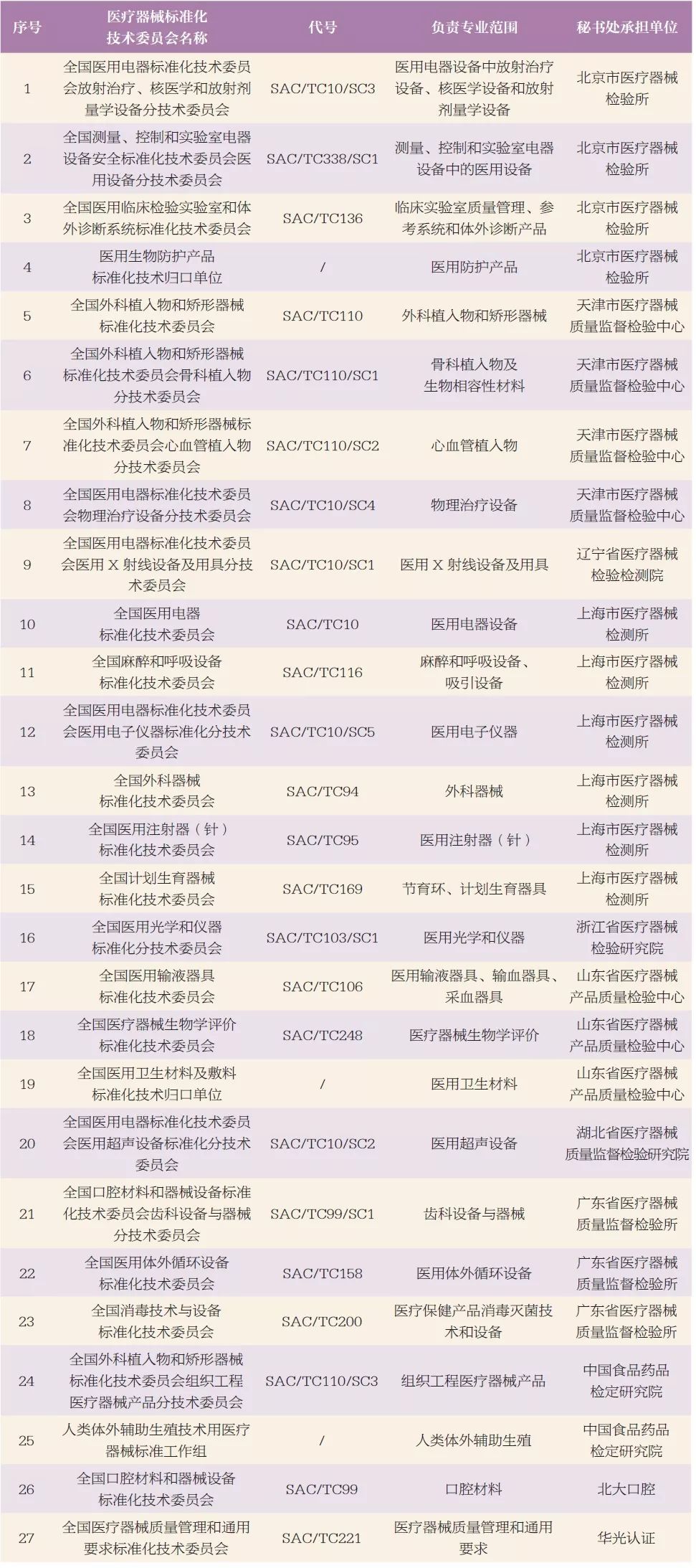
目前,我國已成立24 個醫療器械標準化技術委員會,3 個標準化技術歸口單位。其中全國外科植入物和矯形器械標準化技術委員會有源植入物分技術委員會、全國醫療器械生物學評價標準化技術委員會納米醫療器械生物學評價分技術委員會、醫用增材制造技術標準化技術歸口單位、醫用電聲標準化技術歸口單位、人工智能醫療器械標準化技術歸口單位正在組建中。各醫療器械標準化技術委員會(歸口單位)負責的技術領域和秘書處承擔單位見表1。
表1 醫療器械標準化技術委員會基本信息分布表
3.醫療器械標準概述
截至2018 年10 月,我國共發布醫療器械標準1599 項,基本覆蓋了醫用電氣設備、手術器械、外科植入物等醫療器械產品等技術領域。根據《醫療器械標準管理辦法》,醫療器械標準按以下三種方法進行分類:
按標準使用范圍劃分(即標準層級),分為醫療器械國家標準和行業標準,其數量分布情況見圖1。
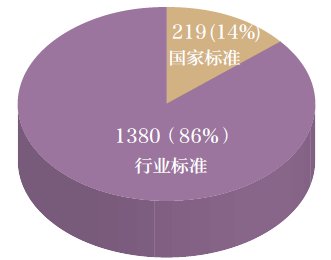
圖1 醫療器械國家標準和行業標準分布圖
按標準效力劃分,分為醫療器械強制性標準、醫療器械推薦性標準和指導性技術文件。其中,強制性標準449 份,推薦性標準1148 份,指導性技術文件2 份。醫療器械國家標準和行業標準按不同約束程度劃分的分布情況見圖2。
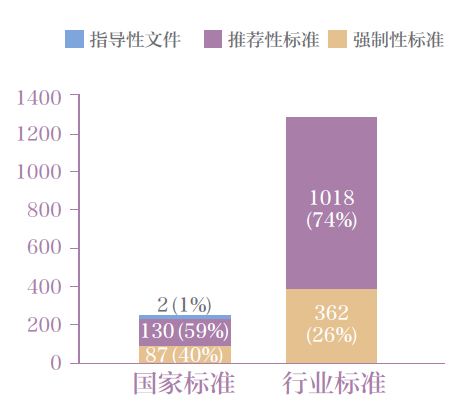
圖2 醫療器械國家和行業標準分布圖
為落實國家標準化改革的總體思路,根據醫療器械監管和產業需求,持續推進醫療器械強制性標準整合精簡工作,醫療器械強制性標準占比正逐年下降,已由2010 年的48% 下降為2018年的28%。

圖3 歷年醫療器械強制性標準占比分布情況
按標準的規范對象劃分,醫療器械標準還可分為基礎標準、管理標準、方法標準和產品標準,其統計分布情況見表2。
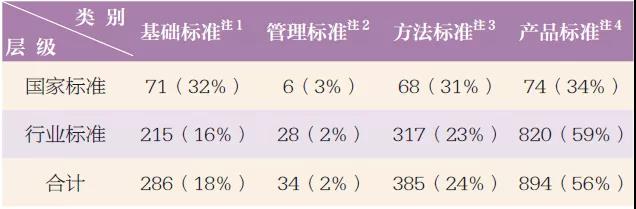
表2 按標準化對象劃分的醫療器械標準統計分布表
注1:基礎標準是指對一個或多個醫療器械技術領域共性要求的標準,如GB9706.1《醫用電氣設備 第1 部分:安全通用要求》、YY/T0066《眼科儀器名詞術語》等。
注2:管理標準是以醫療器械生產質量管理、臨床試驗指南等管理事項為標準化對象的標準,如YY/T0316《醫療器械 風險管理對醫療器械的應用》。
注3:方法標準是以試驗方法、檢驗方法為標準化對象的標準,如GB/T16886《醫療器械生物學評價》系列標準。
注4:產品標準是以某一特定種類的產品需滿足的要求及其對應的試驗方法為標準化對象的標準,如YY0109《醫用超聲霧化器》、YY0500《心血管植入物 人工血管》等。
4.醫療器械標準制修訂程序
醫療器械標準制修訂程序包括標準立項、起草、征求意見、技術審查、批準發布、復審和廢止等環節。對醫療器械監管急需制修訂的標準,可以按照國家食品藥品監督管理總局規定的快速程序開展。為增強標準制修訂過程的公開透明度,新版《醫療器械標準制修訂工作管理規范》增加了立項申請、計劃項目及征求意見稿三個重點環節的公開意見,同時,為保證公眾有充足的時間反饋意見,將立項申請征求意見期限、標準征求意見期限、函審期限予以適當延長,其中標準征求意見期限延長至2 個月,給公眾充足的時間研究標準草案、開展標準驗證并反饋意見。通過這些過程信息的公開,有利于監管部門、生產企業等各利益相關方及時掌握標準制修訂的進程,為各相關方參與標準制修訂工作并反饋意見提供必要條件。
5.醫療器械標準國際合作
國家藥品監督管理局高度重視并深度參與國際標準化治理。目前,醫療器械標準管理中心已和德國標準化組織、美國標準化組織建立了合作關系。2018 年3 月,由醫療器械標準管理中心代表我國提出的《更新IMDRF成員國認可國際標準清單》新工作項目獲一致通過,實現了我國從參與到主導醫療器械國際標準認可規則制定上的歷史性突破。IMDRF 國際標準工作組正按計劃有序推進調研各國采用國際標準情況的技術差異、各國認可國際標準的政策差異等。我國積極參與編寫的IMDRF 指南《提升為監管所用的標準質量》即將發布,我國在優化標準內容、完善標準制定程序等方面的管理經驗將在國際社會得到有效推廣。
后續工作的思考
2015 年,國務院印發《關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44 號),對醫療器械標準工作提出明確要求。2018 年,《中華人民共和國標準化法》發布,中國標準化體系和管理體制面臨重大調整,國家新型標準體系逐步搭建,新的標準化格局正在形成。為進一步貫徹落實《關于改革藥品醫療器械審評審批制度的意見》的有關要求,銜接新版《標準化法》,滿足醫療器械監管和產業發展的新需要,我們要抓住機遇,應對變革,在深入研究的基礎上穩步推進醫療器械標準的發展。
1.加快推進國際標準轉化工作
加快國際標準跟蹤和研究力度,積極推薦標準化人才參加國際標準化組織和工作組,由“被動參與”轉變為“提早介入、主動參與、主導制定”國際標準,第一時間掌握國際標準化工作動態,從而進一步提高醫療器械國際標準的采標率,保持和國際標準水平的一致性程度。
2.進一步完善強制性醫療器械標準管理機制
落實醫療器械強制性標準整合精簡結論,加快整合、修訂步伐,逐步完善醫療器械強制性標準立項條件和工作機制,推進基礎強制性標準制修訂工作,構建結構合理、規模適度、內容科的新型強制性醫療器械標準體系。
3.進一步提高醫療器械標準覆蓋面
繼續加強對移動醫療、新型醫用生物材料、醫用機器人等戰略性新興醫療器械領域技術和標準發展最新動態的調研, 及時了解行業最新發展進程, 準確把握監管和產業需求, 進一步廣泛征集并鼓勵各方提出創新醫療器械標準提案, 并在立項中予以優先考慮, 以科研推動標準制修訂工作。
4.研究探索醫療器械標準實施評價機制
2018 年,醫療器械標準管理中心已組織對YY0505-2012《醫用電氣設備 第1-2 部分:安全通用要求 并列標準:電磁兼容要求和試驗》等26 項醫療器械標準試點開展實施評價,由20個醫療器械標準化技術委員會承擔,將從技術指標、實施情況兩個方面開展評價。通過試點實施效果評價,切實掌握強制性標準實施情況,同時探索科學開展實施評價的思路和方案,為后續全面開展實施評價工作奠定基礎。
小 結
新時代對醫療器械標準化工作提出了新要求和新需求,醫療器械標準管理工作要按照國家監管部門的工作部署和要求,始終堅持為醫療器械監管服務,為促進醫療器械產業發展服務,不斷創新,穩步推進各項工作。
【來源:中國醫藥報微信公眾號】

相關閱讀
- 全面加強疫情防控醫療器械的質量監管2020-04-29
- 各省又有新規定,醫療器械監管呈高壓態勢!2018-06-13
- 數據顯示:國產醫療器械發展進入快車道2015-11-11
- 召回管理制度為醫械上市后監管鋪路2011-10-31






