三部門發文,醫療器械「實名制」擴圍!
第二類醫療器械UDI鋪開,生產、流通、使用環節走向全流程閉環管理,器械監管新生態正在生成。
01醫療器械「身份證」,全鏈條覆蓋
近日,北京市藥監局、北京市衛健委、北京市醫保局發布《關于做好第三批實施醫療器械唯一標識工作的通知》(以下簡稱《通知》),北京市藥監局還制定印發了《北京市醫療器械注冊人備案人唯一標識實施指南》《北京市醫療器械經營企業唯一標識實施指南》《北京市醫療機構醫療器械唯一標識實施指南》。


三份“指南”分別對注冊人、備案人、經營企業、醫療機構多個環節的UDI覆蓋工作提供了指導建議。
主要內容包括建立健全醫療器械唯一標識實施團隊、制度體系建設、具體實施步驟、實施流程圖等,為各單位開展實施應用工作提供參考,確保醫療器械唯一標識實施應用全程可控、提質增效。
北京市藥監局提出,將加快組織推進醫療器械唯一標識制度建設,加強注冊生產流通使用各環節制度研究和推廣應用,促進醫療器械精準化管理,形成從源頭注冊生產到最終臨床使用全鏈條聯動,提高監管效能和社會治理能力。
根據上述公告,北京市藥監局進一步明確,執行第三批醫療器械唯一標識要求,同時“鼓勵其他第二類醫療器械實施唯一標識”。
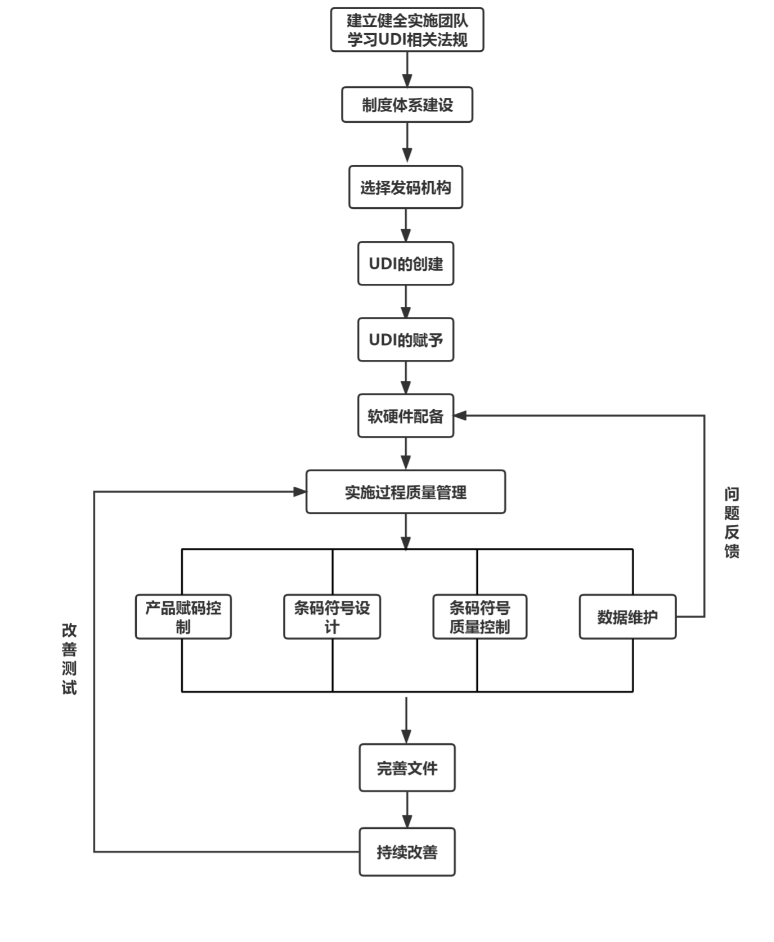
(截圖自《北京市醫療器械注冊人備案人醫療器械唯一標識實施指南》)
今年2月,國家藥監局、國家衛健委、國家醫保局發布《關于做好第三批實施醫療器械唯一標識工作的公告》,其中明確,按照風險程度和監管需要,確定部分臨床需求量較大的一次性使用產品、集中帶量采購中選產品、醫療美容相關產品等部分第二類醫療器械作為第三批醫療器械唯一標識實施品種。
第三批醫療器械唯一標識實施品種共包括103種二類醫療器械,有超聲手術設備、激光手術設備及附件、高頻/射頻手術設備及附件、內窺鏡手術用有源設備、神經和心血管手術器械-心血管介入器械、骨科手術器械、診斷X射線機、光治療設備、起搏系統分析設備、注射泵、臨床檢驗器械等。
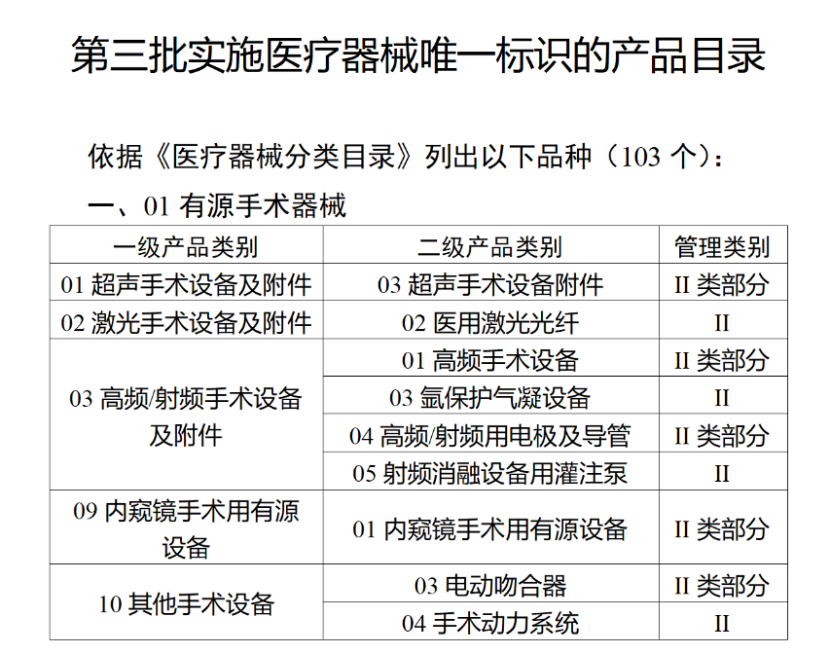
(完整清單附文末)
生產、流通、使用環節實現UDI全覆蓋后,全流程閉環管理也將實現,醫療器械監管將進一步革新。
02「實名制」管理,企業自驅力如何?
事實上,早在全國第三批醫療器械唯一標識正式啟動之前,二類醫療器械UDI編碼已經悄然開始了。
在發碼機構工作的陳振對賽柏藍器械談到,目前很多企業正在推進二類醫療器械的UDI工作,一些企業早在去年就開始推進二類醫療器械的唯一標識。
盡早推進第二類醫療器械唯一標識工作,企業有自己的考量。
陳振談到,醫院要求產品在進入到醫院體系的時候,必須要有UDI編碼和標簽。每個省市也會有不同的要求,一些省份去年就開始推動二類醫療器械UDI了。
據賽柏藍器械觀察,2022年,海南、福建、四川、北京、天津等多省市,陸續發布了有關二類醫療器械唯一標識工作的文件。
“UDI是一個大趨勢,很多企業會自驅地向前推動唯一標識工作。通過編碼去實現內部的一些管控,比如說像防串貨、追溯或者說發貨、防偽等等,都可以通過UDI編碼去做。”
“以往企業采用序列號,但由于每個企業的SN號規則不統一,流通到下游的時候,常常無法通過SN號解析相應的信息。另外在流通環節缺乏有效約束,通過SN號做防偽或者防串,可能會出現被撕掉的情況。”
對于器械企業而言,轉變也并非一蹴而就。
業內人士周軍表示,企業要完善自己UDI的信息系統、管理系統,要做到內外順暢的銜接,這個是需要投入資源的。包括軟硬件的升級還有內部統一協調等,要建立內部的協調機制,要有管理制度和管理規則,需要投入精力和成本。
“唯一標識是從生產源頭開始對醫療器械進行管理,生產企業相關注冊證必須要在規定時間內完成UDI的編碼,然后申報錄入信息系統。而在醫院端,尤其是大三甲醫院,要求企業提供唯一標識,終端需求也會提高企業動力。”
03UDI覆蓋,需各環節聯動配合
按照國家藥監局進度安排,2024年6月1日起生產的醫療器械應當具有唯一標識;此前已生產的第三批實施唯一標識的產品可不具有唯一標識。
然而要想實現生產、流通、使用環節的全流程閉環管理,不僅生產企業需要完成UDI工作,經營企業和醫療機構端的配合也至關重要。
周軍認為,理論上說唯一標識只有實現全流程閉環管理,才能發揮更大的作用。企業端只是其中的一個環節,流通環節和醫院端也要聯動。現在一些醫院要求企業提供UDI碼,但不是所有地區、不是所有醫院。
“醫院屬于衛健體系,這方面現在也在做聯動,只是不同省市、不同的醫院進度有差別,”陳振說,“不過多數醫院都在推進UDI,甚至一些醫院的結算,包括醫保結算,也是通過UDI完成的。因為每個碼是唯一的,它的編碼信息也是根據產品的型號規格,通過掃碼就能夠直接查詢到這些信息,進而完成結算,效率也比較高。”
醫療器械唯一標識生產、流通、使用環節全覆蓋后,監管也將更加透明。
“以召回為例,實現全流程閉環管理后,如果有召回的情形,系統上可以直接監管產品流向,掌握企業是否全部召回。追溯方面實現信息化,理論上監管部門可以通過信息流發現問題,而不是傳統的頻繁現場監督。”周軍談道。
國家藥監局、國家衛健委、國家醫保局今年2月聯合發布的《關于做好第三批實施醫療器械唯一標識工作的公告》中已經明確,醫療器械經營企業要在經營活動中積極應用唯一標識,做好帶碼入庫、出庫,實現產品在流通環節可追溯。
此外,醫療機構要在臨床使用、支付收費、結算報銷等臨床實踐中積極應用唯一標識,做好全程帶碼記錄,實現產品在臨床環節可追溯。
整體來看,醫療器械唯一標識全面鋪開之勢不可阻擋,新的監管時代即將到來。
(應受訪者要求,陳振、周軍為化名)
附件:
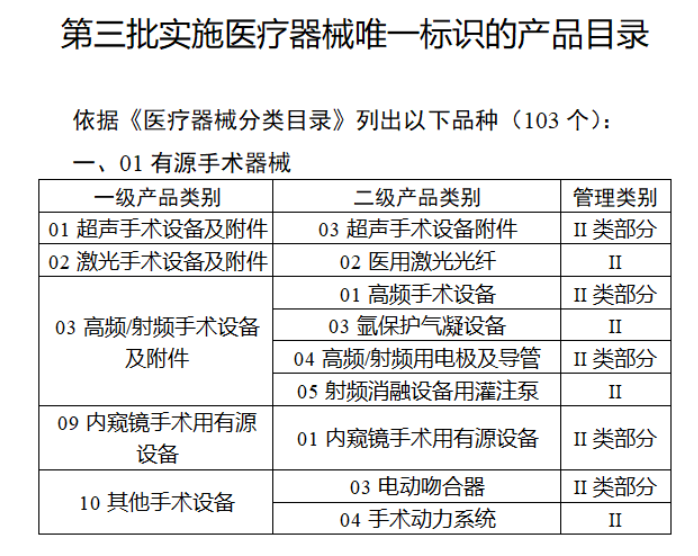
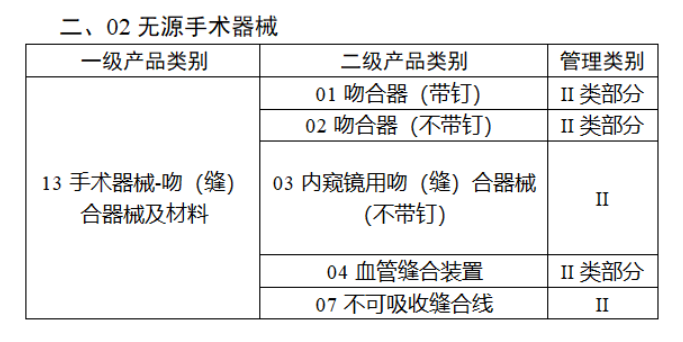
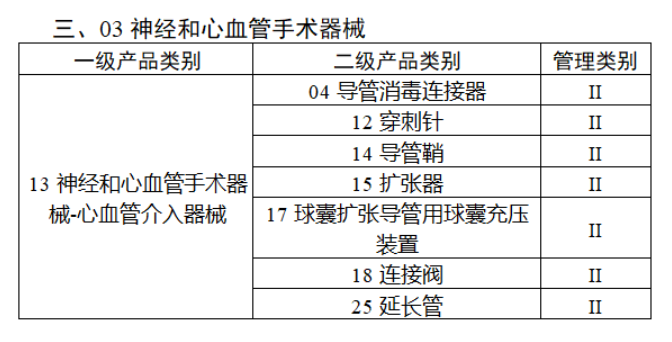


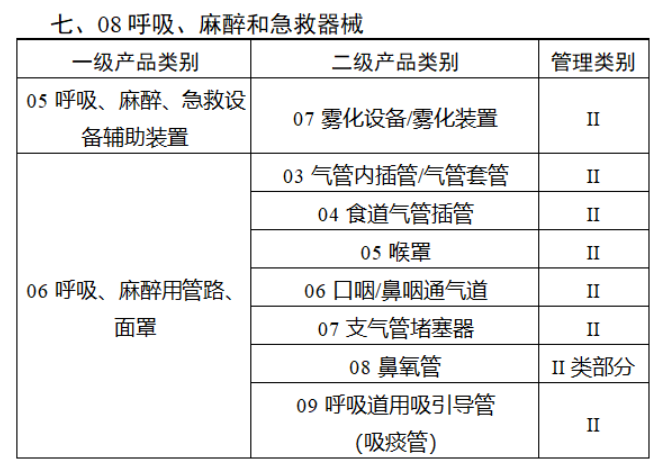
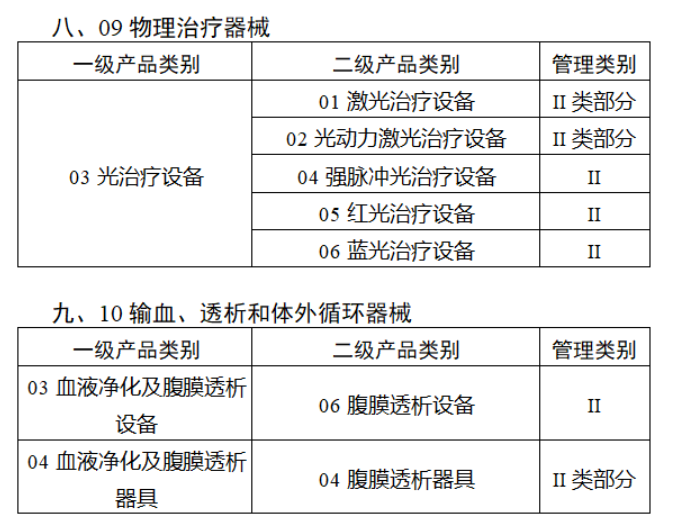
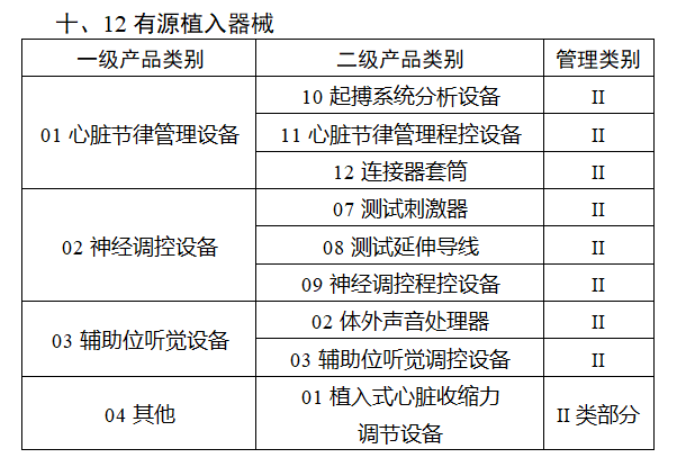
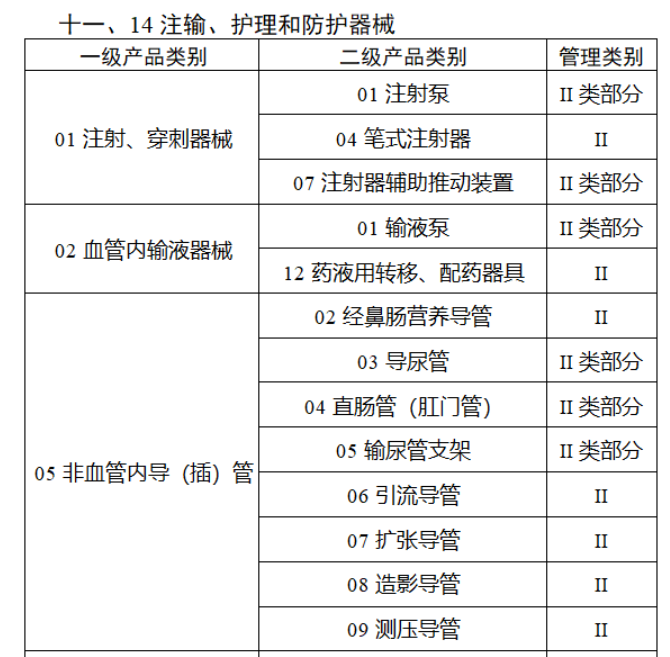
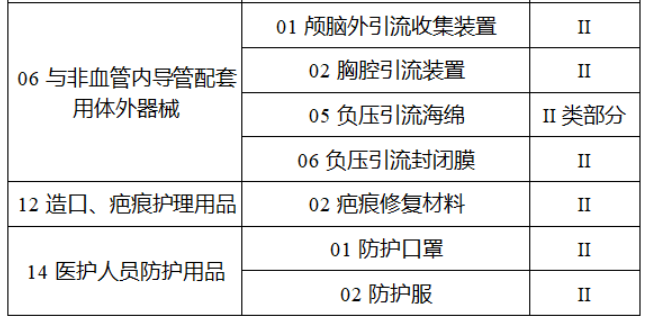
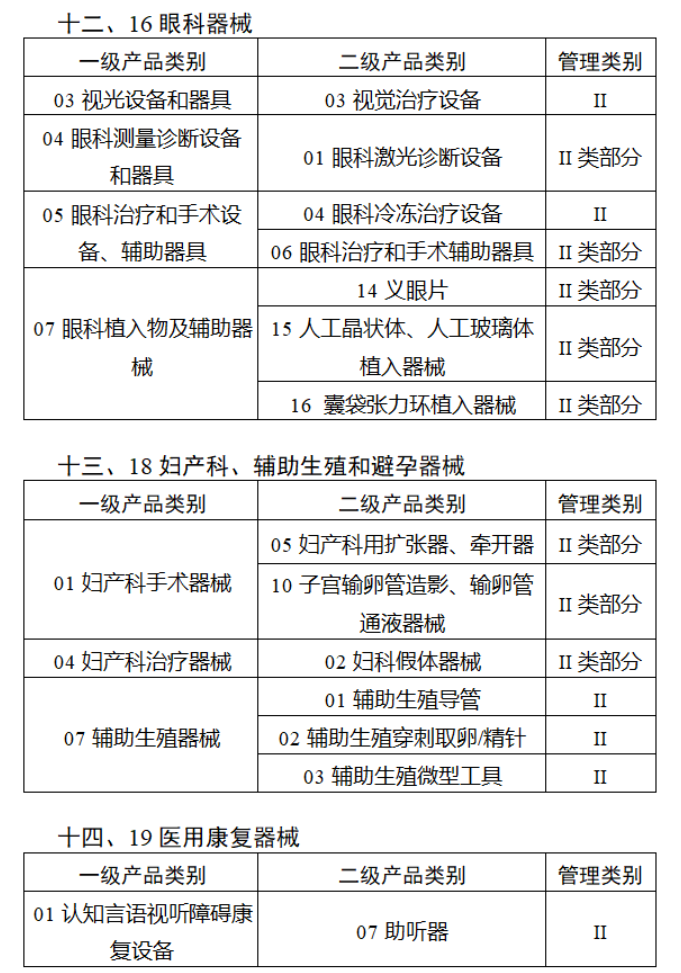
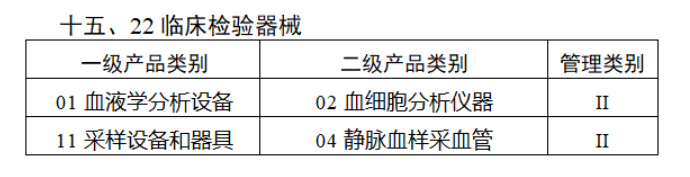
【來源:賽柏藍器械 】

相關閱讀
- 6月1日起,大批醫療器械實名制2024-06-04
- 兩會代表發聲,支持國產高端醫療器械2024-03-08
- 國家醫保局:鼓勵新技術、器械進醫保2023-12-21
- 展會通知 | 2023第49屆中國國際醫療器械(山東)博覽會2023-09-07
- 剛剛!國家開會:鼓勵創新醫療器械上市2023-07-06






